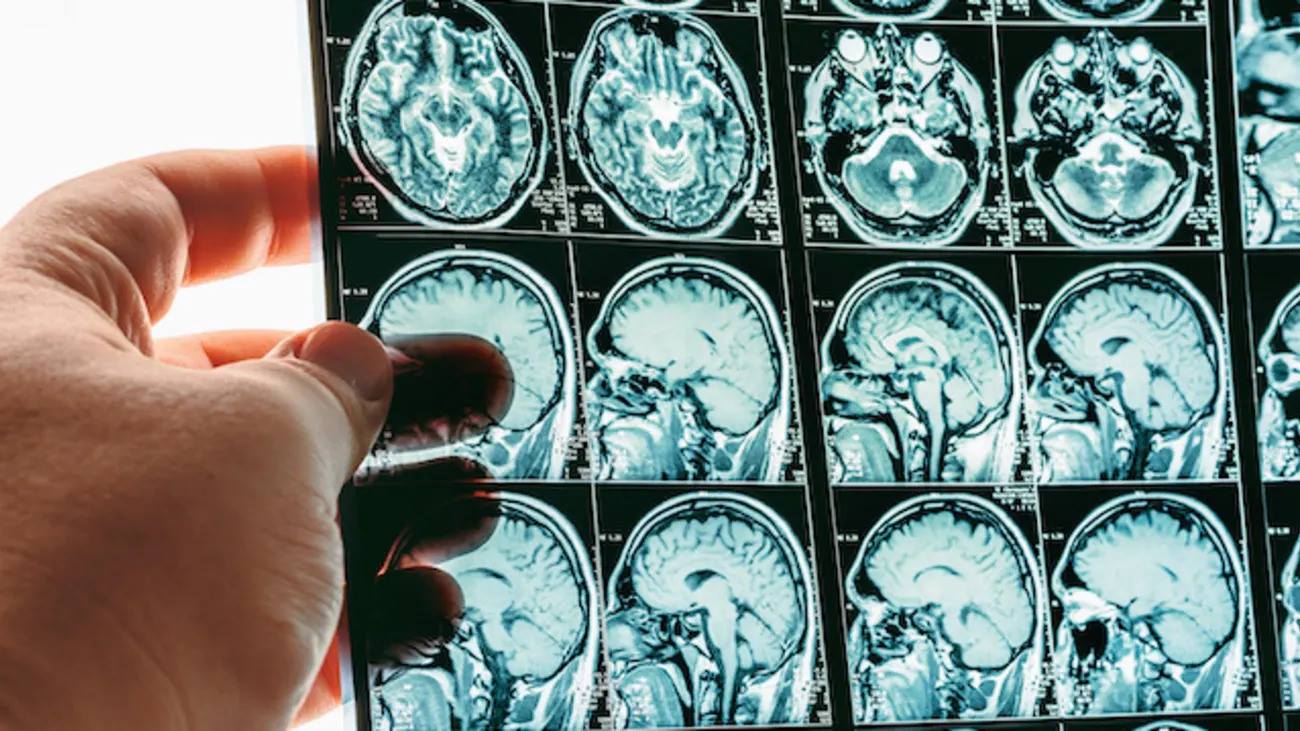
Alzheimer, la Food and Drug Administration americana autorizza l’atteso farmaco di Eisai e Biogen. Negli studi eseguiti il Leqembi ha mostrato risultati promettenti per la cura della malattia, da cui sono affetti circa 6,5 milioni di americani, con un evidente rallentamento della malattia. La Fda ha garantito al farmaco il via libera accelerato e questo significa che le due società dovranno condurre altri studi. Il farmaco costerà 26.500 dollari l’anno a persona, riportano i media americani. «L’Alzheimer è una malattia molto invalidante per chi ne è affetto e ha effetti devastanti per le persone che stanno vicino» ai malati. «Questa opzione di trattamento è l’ultima a prendere di mira il processo sottostante dell’Alzheimer, invece che curare i sintomi della malattia», afferma Billy Dunn della Food and Drug Administration.Le farmaceutiche Eisai e Biogen hanno annunciato i risultati di uno studio di fase III da cui emerge che la molecola sperimentale lecanemab, somministrata nelle prime fasi della malattia, riduce del 27% la progressione dell’Alzheimer. Le aziende hanno anticipato che contano di sottoporre i dossier per l’approvazione del farmaco all’Agenzia europea dei medicinali entro marzo 2023. Lecanemab è un anticorpo monoclonale che riconosce ed elimina gli aggregati di beta-amiloide, il maggior costituente delle placche caratteristiche dell’Alzheimer. La sperimentazione (denominata Clarity AD) ha coinvolto 1.795 persone con decadimento cognitivo lieve dovuto all’Alzheimer e con Alzheimer lieve seguiti per 18 mesi dall’inizio dell’assunzione del farmaco. Rispetto al gruppo di controllo che aveva ricevuto un placebo, i pazienti trattati con lecanemab hanno mostrato una riduzione del 27% del declino cognitivo, misurato con una apposita scala di valutazione definita CDR-SB. Lo studio ha documentato anche una riduzione della quantità di beta-amiloide nel cervello.
Contromano
Esposto-denuncia per stalking contro chi vorrebbe mettere a tacere Italia Notizie sugli incarichi ottenuti in modo illegittimo
di Mario De Michele
Nelle ultime ore sono stato oggetto di un frenetico sciacallaggio social attuato in modo sistematico da un “giovane-vecchio” che ha...
News
Cesa Futura ufficializza la candidatura di Eugenio Oliva nella lista di Fiorillo e indica alcuni punti programmatici
Alla faccia di chi dice strumentalmente o su commissione che Cesa in Comune non parla di contenuti. Essendo inattaccabile, a differenza di altri, lo...












